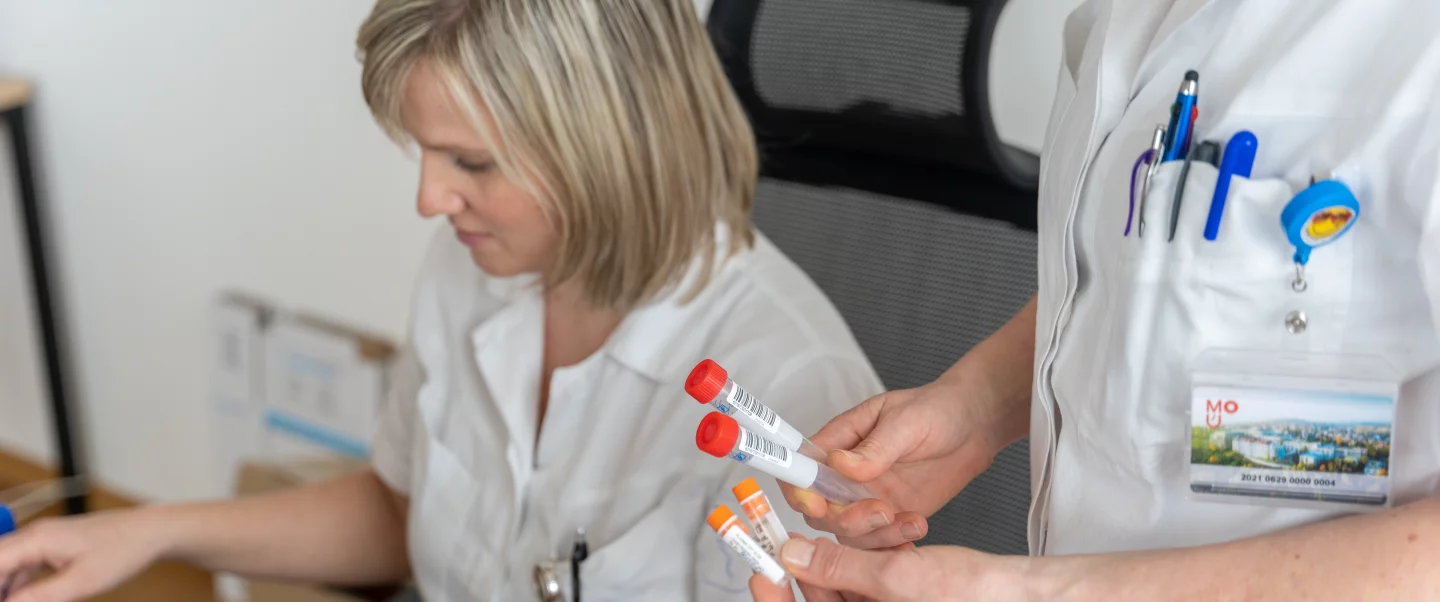
Klinické studie
Při experimentálních výzkumech v laboratoři je cílem objevit nový lék. Klinické studie v oblasti léčby nádorových onemocnění jsou prováděny z důvodu potvrzení bezpečnosti a efektivity nové, slibné léčby. Je však nutno zdůraznit, že před jakoukoli léčbou novým lékem u nemocných pacientů musí být nejdříve provedeno testování v laboratoři. Pouze po potvrzení bezpečnosti léku v laboratoři, popř. na laboratorních zvířatech, může dojít k testování na lidech. V klinických studiích, kterých se účastní pacienti (nebo v některých případech zdraví dobrovolníci). Ověření účinnosti a bezpečnosti nových léků, popřípadě zhodnocení některé nové kombinace s léky již používanými, stanovení účinnějšího dávkování, vylepšení lékové formy (tablety, injekce, čípky atd.). Cíl studie závisí na tom, zda je lék na začátku, uprostřed či v pozdější fázi klinického zkoušení. Na konci studie, která často zahrnuje několik stovek a někdy i tisíc pacientů, jsou shrnuty všechny výsledky. Pokud jsou uspokojivé a léčba novým lékem je dobře tolerována, je lék zaregistrován a stane se přístupným pro lékaře v denní praxi.
1Pro pacienty

Chci být součástí klinické studie
Jak se mohu přihlásit do klinické studie? →
- Klinické studie se řídí podle protokolu, který obsahuje podrobná zařazovací kritéria. Ta musí splnit každý pacient či účastník studie. Máte-li zájem zapojit se do klinické studie, můžete se na tuto možnost dotázat svého ošetřujícího lékaře v MOÚ. Lékaři mají o všech klinických studiích v MOÚ přehled a jistě by Vám možnost účastnit se studie sami nabídli.
- V případě, že se léčíte mimo MOÚ a máte zájem se zapojit do klinické studie, můžete nás kontaktovat na e-mailu [obfuscate_1_|113|116|112|98|102|99|64|104|109|114|44|99|117]
- V případě zájmu o zařazení do studie SCREPAN (screening pankreatu) nás kontaktujte na emailu: [obfuscate_1_|110|114|96|116|98|108|99|96|44|112|106|105|105|103|115|105|97|59|107|108|115|46|94|120]
- Seznam klinických studií s aktuálním náborem naleznete níže v sekci Seznam klinických studií.
- Pro vyhledávání klinických studií v rámci celé ČR doporučujeme webové stránky Státního ústavu pro kontrolu léčiv
- Pro vyhledávání klinických studií v rámci Evropy doporučujeme webové stránky Clinical Trials Register
Chcete se dozvědět více?
Proč jsou klinické studie důležité? →
Klinické studie jsou výzkumné projekty, kterých se mohou pacienti dobrovolně účastnit. Jsou součástí mnoho let trvajícího procesu vývoje nového léčivého přípravku, na jehož konci může být registrace léku a jeho používání v běžné praxi. Mezi časté mýty o klinických studiích patří to, že se jedná o pochybné testování na lidech nebo že je taková léčba nabízena pouze pacientům, kterým již nelze pomoci běžnou léčbou. Ačkoliv je pravda, že se jedná o výzkum, jsou klinické studie běžnou (a nutnou) součástí medicíny a mohou pro pacienty představovat jednu z léčebných možností již od počátku onemocnění. Existují dokonce i studie preventivní, které mají předcházet např. návratu nebo rozšíření nádoru. Cesta každého léku začíná v laboratořích, pokračuje testy na zvířatech a po dlouhém výzkumu se léčivé přípravky, které se prokázaly jako dostatečně bezpečné a účinné, začínají zkoušet v klinických studiích na dobrovolnících, v onkologii z řad pacientů. Všechny studie se řídí zákony a podléhají přísné kontrole úřadů a etických komisí.
Jste v dobrých rukou
V MOÚ mají klinické studie dlouhou tradici. V 70. letech 20. století spolupracovala nemocnice na vývoji nové chemoterapie s farmaceutickou firmou Lachema a od roku 2000 jsou ročně v MOÚ zahajovány na dvě desítky nových klinických studií. Studie se staly běžnou součástí každodenní praxe nemocnice a věnuje se jim řada zkušených lékařů, sester a koordinátorů. Nemocnice prošla úspěšně mnoha audity a inspekcemi. Každý rok zařadíme do klinických studií přes 200 pacientů.
Zobrazit méně →
Jaké jsou fáze klinických studií? →
Klinické studie testují nové léčivé přípravky v několika tzv. fázích.
Studie fáze I: jaká dávka?
Účastníte-li se klinické studie fáze I, znamená to, že se většinou jedná o první podání zkoumaného léku člověku. Těchto studií se účastní na celém světě jen malé množství pacientů (přibližně 15–30).
Hlavním cílem studií první fáze je zpravidla zjistit několik aspektů:
- zda je nová léčba bezpečná, sleduje se její chování v těle pacienta,
- dávku, která je tělem snášena a nezpůsobí výrazné nežádoucí účinky,
- jaký způsob podání je nejlepší (tablety, infuse apod.),
- zda nádor na novou léčbu reaguje (obvykle vedlejší cíl).
Pacienti zařazení do klinických studií fáze I jsou podrobeni intenzivnímu lékařskému dohledu a podání léčby většinou probíhá za hospitalizace. V MOÚ je pro tyto účely vyčleněna speciální lůžková Jednotka fáze I v rámci Kliniky komplexní onkologické péče.
Studie fáze II: pro jaký nádor?
- Do další etapy vývoje postupují pouze ty léčivé přípravky, které úspěšně ukončily první fázi – ukázaly se jako dostatečně bezpečné. V klinických studiích fáze II se obvykle zjišťuje, na jaký typ nádoru nová léčba funguje. Účastní se jich už o něco více pacientů – několik desítek. Vedlejší účinky léčby a její bezpečnost se samozřejmě sledují i nadále v průběhu všech fází klinických studií.
Studie fáze III: jaký účinek?
- Léčivé přípravky, které uspěly i v druhé fázi klinických studií, postupují do konečné předregistrační etapy – studií fáze III. Jedná se o velké mezinárodní klinické studie, kterých se účastní stovky až tisíce pacientů v různých nemocnicích na celém světě. Hlavním cílem studií fáze III je získat odpověď na otázku, zda je nová léčba lepší nebo alespoň stejně dobrá jako ta, která se používá standardně. Jedná se většinou o tzv. randomizované, zaslepené, případně placebem kontrolované studie. Co to znamená?
Termíny klinických studií
- Randomizace je náhodné přidělení léčby, kdy jsou pacienti rozděleni do skupin, tzv. ramen. Jedna skupina pacientů je tak například léčena léčbou standardní (běžně používanou) a druhá skupina je léčena navíc novým testovaným přípravkem. Vlastní randomizaci, tedy rozhodnutí, do které skupiny bude pacient přiřazen, provádí počítač, a je zcela náhodné a anonymní. Lékař nemůže přidělení léčby nijak ovlivnit.
- Abychom předešli chybám při hodnocení účinnosti léčby a výskytu nežádoucích účinků, jsou randomizované studie také často tzv. zaslepené – to znamená, že léčivo je označeno pouze číslem či kódem. Pacient a většinou ani lékař (dvojitě zaslepené studie) tak neví, zda pacient dostává zkoumanou nebo standardní léčbu.
- Některé studie obsahují také podání placeba – tzn. neúčinné látky, která je podávána ve stejné formě jako látka účinná. Placebo může vzbuzovat obavy, v onkologických klinických studiích však není možné, aby pacient, pro jehož onemocnění existuje léčba, dostával pouze neúčinnou látku – k placebu je tedy podávána také běžná léčba. Jedná se opět pouze o možnost srovnání nové a standardní léčby. Na oprávněnost podání placeba dohlíží Etická komise.
- Pokud se nová léčba v rámci tří fází klinických studií ukáže jako dostatečně bezpečná a účinná, může být zaregistrována Státním ústavem na kontrolu léčiv (SÚKL) nebo Evropskou lékovou agenturou (EMA) a používána v běžné praxi. Velké množství zkoumaných léčivých přípravků skončí v raných fázích testování z důvodu nežádoucích účinků nebo malé účinnosti. Pokud však nový lék uspěje, jsou klinické studie šancí dosáhnout na moderní nadějnou léčbu o mnoho let dříve, než začne být lék běžně používán.
Studie fáze IV:
- Klinické studie pokračují i po schválení (registraci) nové léčby. Jejich výhodou je, že mohou probíhat v široké praxi. Cílem postregistračních studií je většinou získat další nové poznatky o nežádoucích účincích léku.
Zobrazit méně →
Čím se klinická studie řídí? →
Způsob, jakým jsou prováděny klinické studie, přesně popisují zákony ČR (zejm. Zákon 378/2007 Sb. a Vyhláška 226/2008 Sb.) i nařízení Evropské unie. Možná se setkáte také s termínem Správná klinická praxe (Good clinical practice, GCP), tedy souborem mezinárodně uznávaných základních principů, které musejí být dodrženy především s ohledem na bezpečnost účastníků studií. Všichni lékaři, sestry a koordinátoři jsou v GCP vyškoleni. V praxi se každá klinická studie řídí tzv. protokolem, který zajišťuje, že bude studie prováděna ve všech nemocnicích na celém světě stejným způsobem a její výsledky tak budou srovnatelné a přesné.
Protokol vytvářejí odborníci pro zadavatele studie (např. farmaceutickou nebo biotechnologickou firmu, akademické pracoviště apod.) a schvaluje jej spolu s celou řadou dalších dokumentů Státní ústav pro kontrolu léčiv (v ČR) a etické komise. Popisuje od A do Z celý průběh studie. Pokud budete do klinické studie zařazen/a, o protokolu v průběhu léčby uslyšíte často. Lékař, který Vám účast ve studii nabízí, je s protokolem dobře obeznámen a je povinen jej také zcela dodržovat. Možná se na začátku dozvíte, že „splňujete“ nebo „nesplňujete„“ kritéria. Tzv. vstupní a vylučující kritéria v protokolu přesně určují, kdo může být do studie zařazen – na základě typu nádoru, předchozí léčby, souběžných onemocnění, výsledků radiologických a laboratorních vyšetření, celkového zdravotního stavu apod. Kritéria musejí být splněna bez výjimky všechna, a to nikoliv proto, aby do studie nemohlo být zařazeno příliš mnoho pacientů, ale naopak – aby byli zařazeni pouze ti, pro které je léčba bezpečná a nadějná a aby výsledky studie byly po celém světě srovnatelné. Protokol dále popisuje, jak bude léčba probíhat, jaké se dají čekat nežádoucí účinky, zda může být léčba přerušena nebo dávka snížena, kdy je nutné provést kontrolní vyšetření, a kdy musí nebo může být účast ve studii ukončena.
Žádná klinická studie nemůže v ČR probíhat bez splnění těchto podmínek:
- schválení Státního ústavu pro kontrolu léčiv,
- schválení etickou komisí/komisemi,
- uzavření smlouvy o provádění klinického hodnocení mezi zadavatelem studie a nemocnicí, jejíž součástí je také povinné pojištění účastníků studie.
Zobrazit méně →
Jak je zajištěna bezpečnost pacientů? →
Bezpečnost pacientů je jednou z priorit klinických studií. Jaké jsou nástroje pro její zajištění?
Dodržování protokolu studie
- Zajištění podpisu Informovaného souhlasu a poučení pacienta,
- kontrola etickými komisemi,
- kontrola Státního ústavu pro kontrolu léčiv, případně dalších orgánů (např. inspekce americké Food and Drug Agency, FDA, nebo Evropské lékové agentury, EMA, audity zadavatelů),
- povinné pojištění účastníků klinických studií,
- dodržování principů Správné klinické praxe.
MOÚ velice dbá na kvalitu provádění klinických studií a v minulých letech úspěšně absolvoval řadu kontrol – ať již ze strany zadavatelů studií, tak i Státního ústavu pro kontrolu léčiv a americké Food and Drug Agency (FDA). Naši práci také kontrolují tzv. monitoři, které zadavatel studie vysílá na pravidelné kontrolní návštěvy, aby každá klinická studie probíhala přesně podle daných pravidel. Veškeré informace k bezpečnosti najdete rovněž v Informovaném souhlasu.
Důležitou informací je také to, že léčba v rámci klinických studií probíhá anonymně, to znamená, že mimo zdravotnické zařízení (např. do farmaceutických firem, zahraničních laboratoří apod.) se v žádném případě nedostanou osobní data pacientů, pouze jejich identifikační číslo (např. M-P 2100345).
Zobrazit méně →
Jaké jsou přínosy a rizika účasti v klinické studii? →
Klinické studie nemusí být vhodné pro každého. Rozhodnutí, zda vstoupit do klinické studie, je pouze na vás. Účast je zcela dobrovolná, a pokud ji odmítnete, nepřinese Vám to žádné sankce nebo nevýhody a bude Vám nabídnuta nejlepší známá standardní léčba. Rozhodování není snadné a budete na něj potřebovat dostatek času a informací, které získáte z Informovaného souhlasu a rozhovoru s lékařem.
Hlavní přínosy účasti v klinické studii:
- přístup k nové protinádorové léčbě dříve, než je obecně dostupná,
- pomoc budoucím či dalším onkologickým pacientům prostřednictvím účasti ve výzkumu nové léčby.
Hlavní rizika účasti v klinické studii:
- dosud nejsou známy všechny nežádoucí účinky zkoumané léčby, a mohou být závažnější, než u léčby standardní,
- jedná se o výzkumný projekt a může se ukázat, že léčba není lepší nebo dokonce stejně dobrá jako standardní protinádorová léčba.
Zobrazit méně →
Jak jsou klinické studie financovány? →
Kdo vlastně za klinickými studiemi stojí a jak se stane, že se lék testuje zrovna ve Vaší nemocnici? Klinickou studii může navrhnout a provádět i samotný lékař, nemocnice či univerzita. Nové léčivé přípravky však v drtivé většině vyvíjejí velké farmaceutické nebo biotechnologické firmy. Vývoj nového léku totiž stojí astronomické částky, až miliardu amerických dolarů. Tomu, kdo klinickou studii organizuje, financuje a odpovídá za její průběh, se říká zadavatel nebo sponzor. Zadavatel si poté vybírá zdravotnická zařízení – tzv. centra, kde bude studii realizovat. Zajímá se zejména o to, aby se jednalo o zkušené, spolehlivé a dobře vybavené zařízení, které se věnuje pacientům vhodným do klinické studie.
Pro pacienta neznamená účast v klinické studii žádné finanční náklady, na druhou strany však rovněž nedostává žádnou finanční odměnu, která je zvykem jen u zdravých dobrovolníků mimo onkologii. Někdy se však stává, že návštěvy v nemocnici jsou častější, než by byly v případě standardní léčby, a je proto nutné zvážit náklady na cestování. Zadavatelé cestovní náklady pacientům proplácí formou peněžní hotovosti nebo poukázek (tzv. stravenek). Léčba, kterou v rámci klinické studie pacient dostává, má však hodnotu až stovek tisíc korun.
Zobrazit méně →
Jak se můžu do klinické studie v MOÚ přihlásit? →
Klinické studie se v MOÚ provádějí pro různé onkologické diagnózy (např. nádory prsu, tlustého střeva a konečníku, ledvin, prostaty, plic, sarkomy, melanom apod.), a zároveň pro různá stádia onemocnění (např. jako léčba pro dosud neléčené nebo naopak předléčené pacienty). Aby mohla být léčba nadějná a efektivní, záleží také dále například na histologickém typu nádoru, jeho velikosti a umístění, na tom, jakou léčbu již pacient má za sebou (některá je dle protokolu povinná, jiná naopak zakázaná) nebo jaké výsledky ukazují radiologická vyšetření (např. CT). Často se musí biologické vzorky (krev, část nádoru) nejprve odeslat na speciální analýzu do zahraničí, aby mohla být léčba skutečně „ušitá na míru„“ typu nádoru.
Na možnost účasti v klinické studii se mohou pacienti nebo jejich blízcí samozřejmě sami dotazovat. Skutečnost, zda můžete být do klinické studie zařazen/a, nicméně posuzuje nakonec vždy lékař (onkolog), který zná protokol klinické studie a zároveň je dobře seznámen s Vaší nemocí. V Masarykově onkologickém ústavu jsou všichni lékaři o probíhajících klinických studií informováni, a pokud by vám některá z těchto studií mohla být aktuálně prospěšná, jistě by vám ji sám nabídl. Každý měsíc takto zařadíme kolem dvaceti nových pacientů.
Zobrazit méně →
Kdo léčbu v rámci klinické studie v nemocnici řídí? →
Klinickým studiím se v MOÚ věnují pouze ti nejzkušenější lékaři. Každá klinická studie má svého vedoucího, tzv. hlavního zkoušejícího. Nemusíte se však bát, že byste kvůli účasti ve studii museli nutně měnit svého ošetřujícího lékaře. Je-li to možné, je tým každé klinické studie stanoven tak, že jsou jeho součástí všichni zkušení lékaři, věnující se dané diagnóze. Dalším důležitým členem týmu je koordinátorka klinické studie z Oddělení klinického hodnocení. Jedná se o zkušenou pracovnici se zdravotnickým vzděláním. Právě u ní bude každá Vaše studiová návštěva začínat a můžete k ní mít plnou důvěru ve všech záležitostech vaší studiové léčby. Součástí týmu každé klinické studie je také farmaceut z Ústavní lékárny, lékař z Oddělení radiodiagnostiky, často také lékař internista, patolog apod. O studii jsou informovány rovněž všechny zdravotní sestry z příslušných pracovišť (stacionář, recepce, lůžková oddělení).
Oddělení klinického hodnocení najdete ve 3. patře Švejdova pavilonu, blízko Informačního a edukačního centra.
Zobrazit méně →
Jak probíhá léčba v rámci klinických studií? →
Informovaný souhlas a práva pacientů
S klinickou studií se můžete setkat v jakékoliv fázi léčby své nemoci. Pokud vám lékař nabídne tzv. „studiovou léčbu“ nebo „studii“ jako jednu z vašich léčebných možností, se svým rozhodnutím nespěchejte. Lékař Vám vysvětlí, o jakou léčbu se jedná a vysvětlí vám, jaký by pro Vás mohla mít přínos. Od lékaře nebo koordinátorky z Oddělení klinického hodnocení (tzv. „studiové oddělení„“) však především dostanete dokument Informovaný souhlas, který si můžete vzít domů a spolu se svými blízkými zvážit všechna pro a proti a připravit si na další návštěvu nemocnice doplňující otázky. Informovaný souhlas popisuje celý průběh léčby, jednotlivá vyšetření, uvádí všechna rizika i očekávané nežádoucí účinky. Pokud s účastí souhlasíte, jeden výtisk, podepsaný lékařem, patří Vám. Je důležité vědět, že svůj souhlas můžete kdykoliv odvolat a ze studie vystoupit, aniž by to mělo vliv na vaši další péči v nemocnici. V opačném případě budete léčeni v rámci studie do té doby, dokud vám bude léčba přínosem nebo dokud její ukončení nestanovuje protokol studie.
Výběr pacienta (screening)
Po podpisu informovaného souhlasu následuje krátké období (většinou 4 týdny), kterému se říká screening (skríning). Během něj podstoupíte řadu vyšetření: např. fyzikální vyšetření lékařem, odběr krve a moči, radiologická vyšetření (CT, RTG, ultrazvuk apod.) nebo vyšetření na Oddělení nukleární medicíny (scintigrafie, PET), lékař se vyptá na podrobnou anamnézu, zjistí, na jaká další onemocnění se léčíte a jaké jiné léky užíváte, protože některé z nich může protokol studie zakazovat. Přesný výčet vyšetření a dalších procedur určuje protokol studie a dozvíte se o nich v Informovaném souhlasu.
Jakmile bude mít lékař výsledky všech vyšetření, ověří, zda skutečně vyhovujete požadavkům klinické studie, které předepisuje protokol. Může se stát, že některé kritérium nesplníte a do studie nebudete moci být zařazen/a. V tom případě vám bude nabídnuta jiná nejlepší dostupná léčba.
Období léčby
Každá klinická studie je jiná a stejně tak se liší jejich léčebný plán (tzv. design studie). Některé jsou jednoduché a pacienti dostávají např. pouze tablety, jiné jsou náročnější a léčba je podávána během hospitalizace nebo ambulantně na stacionáři. Informace o způsobu léčby (chemoterapie, biologická léčba, imunoterapie apod.) a jejím podání (tablety, infuse apod.) budete mít od počátku a budou součástí Vašeho rozhodování.
Váš léčebný plán se řídí podle přehledné tabulky, kterou má k dispozici lékař, koordinátor i zdravotní sestry na ambulancích a je založena ve vaší zdravotní kartě (chorobopise). Díky tomuto přehledu všichni zaměstnanci vědí, kdy Vás objednat na další kontrolu, další podání léčby nebo kontrolní vyšetření tak, aby vše probíhalo podle protokolu. Každou návštěvu (tzv. visitu) zahájíte u své koordinátorky na Oddělení klinického hodnocení. Vyptá se vás na nové zdravotní potíže (možné nežádoucí účinky léčby) a zaznamená si změny v užívaných lécích. Někdy vás může požádat o vyplnění dotazníku, týkající se kvality života. Poté se většinou provádí odběr krve v odběrové místnosti, měření fyziologických funkcí na stacionáři, případně již pacient jde přímo na ambulantní kontrolu nebo na příjem k hospitalizaci. Léčba v klinické studii se řídí také podle vašeho aktuálního zdravotního stavu a lékař může v mezích protokolu léčbu upravovat – např. ji na krátký čas přerušit nebo snížit dávku léku. V případě, že by vám léčba působila vážné nežádoucí účinky (toxicita) nebo v případě, že by Vám již nepomáhala v boji se zhoubným nádorem, byla by vaše aktivní účast ukončena.
Fáze sledování
Po ukončení studiové léčby, ať už z jakéhokoliv důvodu, můžete být ještě různě dlouhou dobu sledování v rámci tzv. follow-up. Ten obnáší občasné kontroly v nemocnici a později například telefonický kontakt.
Co je důležité?
- Vědět, že z klinické studie mohu kdykoliv bez postihu vystoupit,
- zaznamenávat si všechny zdravotní potíže v průběhu studiové léčby, včetně doby, kdy k nim došlo,
- zaznamenávat si všechny léky, které si vezmete nebo změny v jejich užívání,
- nezapomínat co nejdříve hlásit případnou hospitalizaci v jiné nemocnici, informovat o vyšetřeních provedených jinde.
Zobrazit méně →
Co se děje s daty z klinických studií? →
Jelikož se jedná o výzkum, jsou veškeré informace o průběhu Vaší léčby v klinické studii pečlivě zaznamenávány. Lékař zapisuje do běžné zdravotní karty (chorobopisu), koordinátor nebo data manažer pak tyto informace v anonymizované podobě přepisuje do počítačových databází, tzv. Záznamových listů pacienta (Case Report Forms, CRF). Ze všech nemocnic na celém světě, kde studie probíhá, se tímto způsobem shromažďují informace o nežádoucích účincích, průběhu léčby a její účinnosti. Data jsou průběžně kontrolována, ověřována a zkoumána a po ukončení studie je statistici vyhodnotí. Výsledky klinické studie jsou tak dostupné až za velmi dlouhou dobu, až v řádu několika let.
Ochrana vašich osobních dat je zaručena. Veškerá data, která výše popsaným způsobem opouštějí nemocnici, jsou anonymní – uvádí se pouze číslo pacienta, případně iniciály a pohlaví.
Zobrazit méně →
Kde můžu najít informace o klinických studiích probíhajících v ČR? →
Klinické studie probíhají na celém světě, včetně mnoha českých pracovišť. Studie určené pro pacienty se zhoubnými nádory se soustředí zejména do onkologických center, jejichž přehled najdete na stránkách České onkologické společnosti
Databázi všech probíhajících klinických studií nabízí Státní ústav pro kontrolu léčiv najdete zde také pracoviště, kde dané klinické studie probíhají.
Cílený dotaz na možnost zařazení do klinické studie můžete samozřejmě položit přímo svému ošetřujícímu lékaři/lékařce.
Obecné informace o klinických studiích najdete také zde:
Zobrazit méně →
Informace o klinických studiích si můžete přečíst také souhrně v dokumentu Průvodce pacienta klinickými studemi, který je ke stažení níže.
2Pro zadavatele studií

V MOÚ provádíme na špičkové úrovni klinická hodnocení fází I–III v indikacích solidních nádorů. Veškerou komunikaci a agendu zajišťuje a koordinuje Oddělení klinických hodnocení (feasibility, start-up, průběh a koordinace studie, smluvní a ekonomická agenda). Věnujte, prosím, pozornost přiloženým dokumentům.
Máte zájem spolupracovat na klinické studii v MOÚ? →
- Veškeré potřebné dokumenty a dotazníky si můžete stáhnout v sekci Informace pro zadavatele studií.
- V případě nejasností nás můžete kontaktovat e-mailem na [obfuscate_1_|113|116|112|98|102|99|64|104|109|114|44|99|117]
[obfuscate_1_|113|116|112|98|102|99|64|104|109|114|44|99|117]
Etická komise
- Etická komise (EK) plní funkci dle zákona č. 378/2007 Sb., o léčivech, ve znění pozdějších předpisů, a dle zákona č. 123/2000 Sb., o zdravotnických prostředcích, ve znění pozdějších předpisů.
- Cílem činnosti EK je chránit důstojnost a svébytnost lidských bytostí a v rámci své působnosti každému bez rozdílu zaručit úctu k integritě jeho bytosti a ostatní práva a základní svobody při aplikaci biologie a medicíny.
- Etická komise v MOÚ má status lokální EK. Zasedá 1x měsíčně.
- Kompletní informace naleznete na stránkách Etické komise
4Jednotka časných fází
Jednotka časných fází MOÚ byla založena v roce 2012 a její kvalifikovaný tým zajišťuje realizaci klinických hodnocení fází I, včetně first-in human (první podání léčivého prostředku lidskému subjektu).
Lůžková část Jednotky s nepřetržitým provozem je umístěna na Klinice komplexní onkologické péče a disponuje 6 semi intenzivními lůžky s telemetrií. Ambulantní část je umístěna na denním Stacionáři a je vybavena 6 lůžky s telemetrií. Administrativní zázemí zajišťuje Oddělení klinických studií.
5Náš tým
Vedení pracoviště →
Primář Oddělení klinických studií
[obfuscate_1_|112|97|95|105|94|44|111|93|99|111|107|97|105|108|108|116|97|59|107|108|115|46|94|120]
+420 543 13 6237
+420 543 13 6812
Vedoucí Úseku start-up a data managementu
[obfuscate_1_|107|105|94|102|94|99|108|92|44|101|95|110|92|105|108|116|97|59|107|108|115|46|94|120]
+420 543 13 6226
Vedoucí Úseku akademických studií
[obfuscate_1_|107|97|109|114|102|108|97|41|106|108|104|111|113|95|61|107|111|112|44|96|120]
+420 543 13 6232
Vedoucí studijní koordinátor
[obfuscate_1_|113|97|109|105|94|44|115|96|106|115|99|107|96|112|108|116|97|59|107|108|115|46|94|120]
+420 543 13 6241
Zaměstnanci →
Medicínský zástupce CZECRIN
[obfuscate_1_|112|101|98|103|107|95|46|95|99|106|106|111|113|95|61|107|111|112|44|96|120]
+420 543 13 6226
+420 543 13 6611
THP - administrativní a spisový pracovník
[obfuscate_1_|105|97|111|99|111|103|110|92|44|95|99|110|96|113|108|116|97|59|107|108|115|46|94|120]
+420 543 13 6234
Start-up koordinátorka
[obfuscate_1_|102|97|105|95|43|96|108|92|102|118|108|107|106|116|94|62|109|106|115|43|97|122]
+420 543 13 6233
[obfuscate_1_|95|108|96|118|94|108|100|109|95|43|97|104|106|107|108|116|97|59|107|108|115|46|94|120]
+420 543 13 6235
THP - administrativní a spisový pracovník
[obfuscate_1_|103|118|92|108|94|44|100|92|113|104|109|118|92|62|106|109|117|41|97|119]
+420 543 13 6225
Data manažer
[obfuscate_1_|104|97|105|95|43|102|97|100|97|106|95|110|106|116|94|62|109|106|115|43|97|122]
+420 543 13 6235
Výzkumný pracovník
[obfuscate_1_|112|101|105|95|113|95|46|99|109|111|109|118|92|62|106|109|117|41|97|119]
+420 543 13 6247
Výzkumný pracovník
[obfuscate_1_|98|97|109|103|94|44|104|112|98|112|110|101|111|102|61|107|111|112|44|96|120]
+420 543 13 6229
Data manažer
[obfuscate_1_|99|114|100|105|94|44|107|104|99|107|114|111|113|95|61|107|111|112|44|96|120]
+420 543 13 6235
Výzkumný pracovník
[obfuscate_1_|96|97|109|96|108|112|97|41|112|102|102|111|113|95|61|107|111|112|44|96|120]
+420 543 13 6226
Všeobecná sestra S4
[obfuscate_1_|99|118|92|44|112|114|117|95|99|107|95|64|104|109|114|44|99|117]
+420 543 13 6242
Výzkumný pracovník
[obfuscate_1_|104|97|105|95|43|116|108|94|105|108|116|97|59|107|108|115|46|94|120]
+420 543 13 6238
Výzkumný pracovník
[obfuscate_1_|105|108|92|112|94|44|99|99|112|108|107|97|59|107|108|115|46|94|120]
+420 543 13 6239
výzkumný pracovník - IPO
[obfuscate_1_|108|97|95|95|43|102|111|105|105|108|116|97|59|107|108|115|46|94|120]
+420 543 13 6249
výzkumný pracovník - CZECRIN
[obfuscate_1_|114|101|109|99|119|95|46|100|108|104|109|118|92|62|106|109|117|41|97|119]
+420 543 13 6245
výzkumný pracovník - IPO
[obfuscate_1_|98|105|111|95|43|105|111|117|95|104|109|118|92|62|106|109|117|41|97|119]
+420 543 13 5401
výzkumný pracovník - IPO
[obfuscate_1_|103|118|96|114|94|44|115|96|106|102|108|103|96|112|108|116|97|59|107|108|115|46|94|120]
+420 543 13 6720
Výzkumný pracovník
[obfuscate_1_|110|101|111|112|94|44|115|111|95|112|114|110|92|62|106|109|117|41|97|119]
+420 543 13 6240
výzkumný pracovník - CZECRIN
[obfuscate_1_|114|101|109|99|119|95|46|110|114|98|110|97|105|105|108|116|97|59|107|108|115|46|94|120]
+420 543 13 6223
Všeobecná sestra - 305/304/303
[obfuscate_1_|103|118|92|44|97|116|111|109|95|104|109|118|92|62|106|109|117|41|97|119]
+420 543 13 6242
Všeobecná sestra - 305/304/303
[obfuscate_1_|95|108|100|97|98|44|104|109|115|112|105|111|113|95|61|107|111|112|44|96|120]
+420 543 13 6227
Výzkumný pracovník
[obfuscate_1_|112|101|105|95|113|95|46|99|115|111|108|105|102|109|115|95|64|104|109|114|44|99|117]
+420 543 13 6243
Všeobecná sestra - 305/304/303
[obfuscate_1_|105|97|111|99|111|103|110|92|44|104|108|101|94|102|113|109|118|92|62|106|109|117|41|97|119]
+420 543 13 6248
Všeobecná sestra - 305/304/303
[obfuscate_1_|116|105|102|114|108|112|46|102|109|106|103|110|96|105|61|107|111|112|44|96|120]
+420 543 13 6246
Všeobecná sestra - 305/304/303
[obfuscate_1_|96|111|99|115|106|103|108|92|44|109|95|118|103|95|112|109|118|92|62|106|109|117|41|97|119]
+420 543 13 6222
[obfuscate_1_|105|97|111|99|111|103|110|92|44|109|95|118|103|103|96|105|111|113|95|61|107|111|112|44|96|120]
+420 543 13 6236
Všeobecná sestra - 305/304/303
[obfuscate_1_|108|97|111|95|105|103|101|41|110|108|97|104|106|110|108|116|97|59|107|108|115|46|94|120]
+420 543 13 6244
Všeobecná sestra - 305/304/303
[obfuscate_1_|98|97|105|95|43|110|114|106|97|101|95|122|102|109|115|95|64|104|109|114|44|99|117]
+420 543 13 6229
Všeobecná sestra - 305/304/303
[obfuscate_1_|106|101|105|105|94|44|114|96|116|102|106|97|102|109|115|95|64|104|109|114|44|99|117]
+420 543 13 6227
Výzkumný pracovník
[obfuscate_1_|107|97|109|105|98|114|97|41|113|104|109|117|107|95|61|107|111|112|44|96|120]
+420 543 13 6224
Všeobecná sestra - 305/304/303
[obfuscate_1_|105|97|111|99|111|103|110|92|44|115|95|118|109|109|114|97|104|106|116|94|62|109|106|115|43|97|122]
+420 543 13 6220
Všeobecná sestra - 305/304/303
[obfuscate_1_|107|97|109|97|98|106|97|41|117|98|108|105|110|97|101|109|118|92|62|106|109|117|41|97|119]
+420 543 13 6231
6Ukazatele kvality
MOÚ je největší onkologické centrum v ČR a od roku 2023 jediný český držitel akreditace Comprehensive cancer center Organizace evropských onkologických ústavů (OECI) , splňujeme vysoké požadavky v oblasti klinického výzkumu.
- rychlost a kvalita zadávání dat do eCRF – je zajištěno 6 data manažery Oddělení klinických studií, zadání dat do 2–5 dní po studijní návštěvě nebo dle požadavků zadavatele
- rychlost start-up fáze KH – je zajištěno start-up týmem OKS. Více informací pro zadavatele studií najdete zde
- udržení drop-out rate 0 %
7Den s koordinátorkou klinických studií
Zajímává vás jak fungují klinické studie v Masarykově onkologickém ústavu? Podívejte se na video mapující jeden pracovní den studijní koordinátorky.
8Informace o klinických studiích
Seznam klinických studií s náborem pacientů
Randomizovaná, otevřená studie fáze III, srovnávající Sacituzumab Tirumotecan v monoterapii nebo v kombinaci s pembrolizumabem oproti léčbě zvolené lékařem u pacientů s neléčeným lokálně pokročilým nebo metastatickým triple negativním karcinomem prsu.
Kód studie: 48/2025 fáze III
Číslo protokolu: MK-2870-011
Diagnózy: C500-C509
Hlavní zkoušející: MUDr. Karina Oršulová
Koordinátoři:
Bc. Renata Hurníková
tel.: 6243,
e-mail: [obfuscate_1_|112|101|105|95|113|95|46|99|115|111|108|105|102|109|115|95|64|104|109|114|44|99|117]
Datum zahájení: 13. 10. 2025
Nábor probíhá
Randomizovaná, otevřená studie fáze III hodnotící saruparib (AZD5305) plus camizestrant ve srovnání s přípravkem dle volby lékaře, CDK4/6 inhibitorem a ET nebo s camizestrantem, pro léčbu první linie pacientů s BRCA1, BRCA2 nebo mutacemi PALB2, pozitivní receptory hormonu, HER 2 neg. u pacientů s pokročilým Ca prsu.
Kód studie: 36/2025 fáze III
Číslo protokolu: D9722C00001
Diagnózy: všechny
Hlavní zkoušející: MUDr. Miloš Holánek, Ph.D.
Koordinátoři:
Bc. Iva Dvořáková
tel.: 6242,
e-mail: [obfuscate_1_|103|118|92|44|97|116|111|109|95|104|109|118|92|62|106|109|117|41|97|119]
Datum zahájení: 14. 10. 2025
Nábor probíhá
Otevřená studie fáze I zaměřená na stanovení dávky a rozšíření BI 765179 v monoterapii a v kombinaci s ezabenlimabem (BI 754091) u pacientů s pokročilými solidními nádory a BI 765179 v kombinaci s pembrolizumabem v první linii PD-L1-pozitivního metastatického nebo nevyléčitelného, recidivujícího spinocelulárního karcinomu hlavy a krku (HNSCC)
Kód studie: 35R/2025 fáze Ib
Číslo protokolu: 1463-0001
Diagnózy: C000-C140
Hlavní zkoušející: MUDr. Peter Grell, Ph.D.
Koordinátoři:
Bc. Kateřina Vavrouchová
tel.: 6220,
e-mail: [obfuscate_1_|105|97|111|99|111|103|110|92|44|115|95|118|109|109|114|97|104|106|116|94|62|109|106|115|43|97|122]
Datum zahájení: 26. 9. 2025
Nábor probíhá
Intervenční, otevřené, randomizované, multicentrické klinické hodnocení fáze 3 léčiva PF-07220060 v kombinaci s letrozolem v porovnání s inhibitorem CDK4/6 v kombinaci s letrozolem u účastníků starších 18 let s pokročilým/metastatickým karcinomem prsu s pozitivním hormonálním receptorem (HR) a negativním receptorem (HER2), kterým dosud nebyla podána systémová protinádorová léčba pro pokročilé/metastatické onemocnění (FourLight-3)
Kód studie: 15/2025 fáze III
Číslo protokolu: C4391024
Diagnózy: všechny
Hlavní zkoušející: doc. MUDr. Jana Halámková, Ph.D.
Koordinátoři:
Bc. Natálie Pochopová
tel.: 6248,
e-mail: [obfuscate_1_|108|97|111|95|105|103|101|41|110|108|97|104|106|110|108|116|97|59|107|108|115|46|94|120]
Datum zahájení: 23. 6. 2025
Nábor probíhá
Kód studie: 8A/2025 fáze IV
Číslo protokolu: MOU-2024-01
Diagnózy: všechny
Hlavní zkoušející: MUDr. Lenka Pavčíková
Datum zahájení: 2. 5. 2025
Nábor probíhá
A Phase 1 Multicenter, Open-Label, Dose-Escalation, Safety, Pharmacokinetic, Pharmacodynamic, and Clinical Activity Study of Orally Administered EP102 monotherapy in Participants with Advanced Solid Tumors
Kód studie: 3F/2025 fáze I
Číslo protokolu: EP102-101
Diagnózy: všechny
Hlavní zkoušející: doc.MUDr.Radka Lordick Obermannová, PhD.
Koordinátoři:
Mgr. Lenka Reviľáková
tel.: 6227,
e-mail: [obfuscate_1_|106|101|105|105|94|44|114|96|116|102|106|97|102|109|115|95|64|104|109|114|44|99|117]
Datum zahájení: 7. 8. 2025
Nábor probíhá
An open-label, multi-center, phase I/II study of ECI830 as a single agent and in combination with ribociclib and endocrine therapy in patients with advanced hormone receptor positive, HER2-negative breast cancer and advanced solid tumors
Kód studie: 50F/2024 fáze I/II
Číslo protokolu: CECI830A12101
Diagnózy: všechny
Hlavní zkoušející: MUDr. Peter Grell, Ph.D.
Koordinátoři:
Mgr. Lenka Reviľáková
tel.: 6227,
e-mail: [obfuscate_1_|106|101|105|105|94|44|114|96|116|102|106|97|102|109|115|95|64|104|109|114|44|99|117]
Datum zahájení: 6. 11. 2025
Nábor probíhá
Randomizované, otevřené, adaptivní klinické hodnocení fáze III s dvěma částmi porovnávající přípravek BMS-986365 s terapií dle výběru zkoušejícího zahrnující buď docetaxel nebo druhý inhibitor androgenního receptoru (ARPI) u účastníků s metastatickým kastračně rezistentním karcinomem prostaty
Kód studie: 45/2024 fáze III
Číslo protokolu: CA0711000
Diagnózy: C61
Hlavní zkoušející: MUDr. Jiří Navrátil, Ph.D.
Koordinátoři:
Bohumila Pavlasová
tel.: 6222,
e-mail: [obfuscate_1_|96|111|99|115|106|103|108|92|44|109|95|118|103|95|112|109|118|92|62|106|109|117|41|97|119]
Datum zahájení: 13. 6. 2025
Nábor probíhá
Randomizované, dvojitě zaslepené, multicentrické klinické hodnocení fáze III přípravku BMS-986489 (kombinace BMS-986012 a nivolumabu ve fixní dávce) v kombinaci s karboplatinou a etoposidem oproti atezolizumabu v kombinaci s karboplatinou a etoposidem jako první linie léčby účastníků s malobuněčným karcinomem plic v rozsáhlém stádiu (TIGOS)
Kód studie: 42/2024 fáze III
Číslo protokolu: CA2450001
Diagnózy: C340
Hlavní zkoušející: MUDr. Ján Podhorec
Koordinátoři:
Marcela Wenischová
tel.: 6231,
e-mail: [obfuscate_1_|107|97|109|97|98|106|97|41|117|98|108|105|110|97|101|109|118|92|62|106|109|117|41|97|119]
Datum zahájení: 29. 4. 2025
Nábor probíhá
A Phase 1/2 Open-Label, Umbrella Platform Design Study of Investigational Agents in Combination With Pembrolizumab (MK-3475) With or Without Chemotherapy in Participants With 1L Locally Advanced Unresectable/Metastatic Esophageal Cancer: KEYMAKER-U06 Substudy 06E
Kód studie: 41R/2024 fáze Ib
Číslo protokolu: MK-3475-06E
Diagnózy: C15 -C159
Hlavní zkoušející: doc.MUDr.Radka Lordick Obermannová, PhD.
Koordinátoři:
Bc. Kateřina Vavrouchová
tel.: 6220,
e-mail: [obfuscate_1_|105|97|111|99|111|103|110|92|44|115|95|118|109|109|114|97|104|106|116|94|62|109|106|115|43|97|122]
Datum zahájení: 11. 9. 2025
Nábor probíhá
Randomizovaná, otevřená studie fáze III srovnávající přípravek rinatabart sesutecan a léčbu zvolenou zkoušejícím lékařem u pacientek s Ca ovarií rezistentním na platinu
Kód studie: 36/2024 fáze
Číslo protokolu: GCT1184-02
Diagnózy: všechny
Hlavní zkoušející: MUDr. Mária Zvaríková
Koordinátoři:
Bc. Iva Dvořáková
tel.: 6242,
e-mail: [obfuscate_1_|103|118|92|44|97|116|111|109|95|104|109|118|92|62|106|109|117|41|97|119]
Datum zahájení: 19. 12. 2025
Nábor probíhá
Randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie fáze 3, srovnávající Elacestrant plus Everolimus oproti Elacestrantu u pacientů s HR pozitivním a HER2 negativním pokročilým karcinomem prsu, s mutací genu ESR1 po progresi na léčbě IA a inhibitory CDK4/6
Kód studie: 32/2024 fáze III
Číslo protokolu: MEDOPP545
Diagnózy: C500-C509
Hlavní zkoušející: MUDr. Miloš Holánek, Ph.D.
Koordinátoři:
Bc. Renata Hurníková
tel.: 6243,
e-mail: [obfuscate_1_|112|101|105|95|113|95|46|99|115|111|108|105|102|109|115|95|64|104|109|114|44|99|117]
Datum zahájení: 16. 5. 2025
Nábor probíhá
Neitervenční studie biomarkerů se zaměřením na molekulární testování archivní nádorové tkáně u účastníků s pokročilými nebo metastatickými malignitami.
Kód studie: 31/2024 fáze
Číslo protokolu: 20230246
Diagnózy: všechny
Hlavní zkoušející: MUDr. Stanislav Špelda
Koordinátoři:
Mgr. Viktor Komínek
tel.: 6246,
e-mail: [obfuscate_1_|116|105|102|114|108|112|46|102|109|106|103|110|96|105|61|107|111|112|44|96|120]
Datum zahájení: 14. 3. 2025
Nábor probíhá
Multicentrické, otevřené klinické hodnocení fáze III, hodnotící Elacestrant vs standardní ET u pacientů s pozitivními uzlinami, ER+, HER 2 -, s vysokým rizikem rekurence.
Kód studie: 24/2024 fáze III
Číslo protokolu: STML-ELA-0422
Diagnózy: C500-C509
Hlavní zkoušející: MUDr. Markéta Palácová
Koordinátoři:
Bc. Iva Dvořáková
tel.: 6242,
e-mail: [obfuscate_1_|103|118|92|44|97|116|111|109|95|104|109|118|92|62|106|109|117|41|97|119]
Datum zahájení: 11. 4. 2025
Nábor probíhá
Klinické hodnocení zjišťující více o tom, jak je přípravek BAY 2927088 v porovnání se standardní léčbou účinný a jak je bezpečný u účastníků s pokročilým stadiem nemalobuněčného karcinomu plic (NSCLC) s mutacemi v genech receptoru lidského epidermálního růstového faktoru 2 (HER2)
Kód studie: 23/2024 fáze III
Číslo protokolu: SOHO - 22615
Diagnózy: C340
Hlavní zkoušející: MUDr. Ján Podhorec
Koordinátoři:
Marcela Wenischová
tel.: 6231,
e-mail: [obfuscate_1_|107|97|109|97|98|106|97|41|117|98|108|105|110|97|101|109|118|92|62|106|109|117|41|97|119]
Datum zahájení: 19. 11. 2024
Nábor probíhá
DESTINY-Biliary Tract Cancer-01: Klinické hodnocení fáze III k vyhodnocení kombinace trastuzumab deruxtekan (T-DXd) a rilvegostomig vs. standardní léčba ve formě gemcitabinu, cisplatiny a durvalumabu v první linii u lokálně pokročilého nebo metastatického karcinomu žlučových cest s expresí HER2
Kód studie: 16/2024 fáze III
Číslo protokolu: D781PC00001
Diagnózy: všechny
Hlavní zkoušející: prof. MUDr. Igor Kiss, Ph.D., MBA
Koordinátoři:
Bc. Markéta Skoupá
tel.: 6224,
e-mail: [obfuscate_1_|107|97|109|105|98|114|97|41|113|104|109|117|107|95|61|107|111|112|44|96|120]
Datum zahájení: 13. 11. 2025
Nábor probíhá
Psilocybin - strategie rychlé antidepresivní odpovědi u deprese komorbidní s onkologickým onemocněním
Kód studie: 12A/2024 fáze II
Číslo protokolu: PSIKET_002CZE
Diagnózy: všechny
Hlavní zkoušející: MUDr. Ondřej Sláma, Ph.D.
Koordinátoři:
Bc. Natálie Pochopová
tel.: 6248,
e-mail: [obfuscate_1_|108|97|111|95|105|103|101|41|110|108|97|104|106|110|108|116|97|59|107|108|115|46|94|120]
Datum zahájení: 28. 2. 2025
Nábor probíhá
CARE1
Kód studie: 9A/2024 fáze III
Číslo protokolu: CSET 2023/3764
Diagnózy: C64
Hlavní zkoušející: doc. MUDr. Alexandr Poprach, Ph.D.
Koordinátoři:
Bc. Markéta Skoupá
tel.: 6224,
e-mail: [obfuscate_1_|107|97|109|105|98|114|97|41|113|104|109|117|107|95|61|107|111|112|44|96|120]
Datum zahájení: 25. 3. 2025
Nábor probíhá
Randomizované, nezaslepené klinické hodnocení fáze 3, jehož cílem je porovnat účinnost a bezpečnost adjuvantní léčby přípravkem MK-2870 v kombinaci s pembrolizumabem (MK-3475) oproti terapii zvolené lékařem u pacientů s triple negativním karcinomem prsu (TNBC), kteří absolvovali neoadjuvantní léčbu, a v době operace nedosáhli patologické kompletní odpovědi (pCR).
Kód studie: 5/2024 fáze III
Číslo protokolu: MK-2870-012
Diagnózy: C500-C509
Hlavní zkoušející: MUDr. Katarína Petráková, Ph.D.
Koordinátoři:
Bc. Renata Hurníková
tel.: 6243,
e-mail: [obfuscate_1_|112|101|105|95|113|95|46|99|115|111|108|105|102|109|115|95|64|104|109|114|44|99|117]
Datum zahájení: 3. 9. 2024
Nábor probíhá
RANDOMIZOVANÉ, OTEVŘENÉ KLINICKÉ HODNOCENÍ FÁZE 3 U PACIENTŮ S DŘÍVE LÉČENÝM NERESEKOVATELNÝM NEBO METASTATICKÝM MELANOMEM S NRAS MUTACÍ POROVNÁVAJÍCÍ KOMBINACI NAPORAFENIBU A TRAMETINIBU S LÉČBOU PODLE VOLBY LÉKAŘE (DAKARBAZIN, TEMOZOLOMID NEBO MONOTERAPIE TRAMETINIBEM) S ÚVODNÍ OPTIMALIZACÍ DÁVKY
Kód studie: 4/2024 fáze III
Číslo protokolu: ERAS-254-02
Diagnózy: C430-C439
Hlavní zkoušející: doc. MUDr. Radek Lakomý, Ph.D.
Koordinátoři:
Bc. Markéta Skoupá
tel.: 6224,
e-mail: [obfuscate_1_|107|97|109|105|98|114|97|41|113|104|109|117|107|95|61|107|111|112|44|96|120]
Datum zahájení: 15. 11. 2024
Nábor probíhá
Fáze III, otevřená, nezaslepená studie u pacientů se squamózním NSCLC stádia IV s indukční chemoterapií Pembrolizumab + Carboplatina + Paklitaxel/Nab-paklitaxel a následnou udržovací léčbou Pembrolizumab vs. Pembrolizumab + MK2870
Kód studie: 44/2023 fáze III
Číslo protokolu: MK-2870-023
Diagnózy: C349
Hlavní zkoušející: MUDr. Ondřej Bílek, Ph.D.
Koordinátoři:
Mgr. Viktor Komínek
tel.: 6246,
e-mail: [obfuscate_1_|116|105|102|114|108|112|46|102|109|106|103|110|96|105|61|107|111|112|44|96|120]
Datum zahájení: 11. 10. 2024
Nábor probíhá
Randomizovaná, dvojitě zaslepená, placebem kontrolovaná klinická studie fáze III přípravku Ficlatuzumab v kombinaci s přípravkem Cetuximab u účastníků s recidivujícím nebo metastatickým HPV-negativním dlaždicobuněčným karcinomem hlavy a krku
Kód studie: 38/2023 fáze III
Číslo protokolu: AV-299-23-301
Diagnózy: C000-C140,C300-C320
Hlavní zkoušející: MUDr. Andrea Jurečková
Koordinátoři:
Bc. Iva Dvořáková
tel.: 6242,
e-mail: [obfuscate_1_|103|118|92|44|97|116|111|109|95|104|109|118|92|62|106|109|117|41|97|119]
Datum zahájení: 21. 10. 2024
Nábor probíhá
Randomizovaná, otevřená studie fáze III hodnotící saruparib (AZD5305) plus camizestrant ve srovnání s přípravkem dle volby lékaře, CDK4/6 inhibitorem a ET nebo s camizestrantem, pro léčbu první linie pacientů s BRCA1, BRCA2 nebo mutacemi PALB2, pozitivní receptory hormonu, HER 2 negativní.
Kód studie: 36/2023 fáze III
Číslo protokolu: AZD5305-D9722C00001
Diagnózy: C500-C509
Hlavní zkoušející: MUDr. Miloš Holánek, Ph.D.
Koordinátoři:
Bc. Iva Dvořáková
tel.: 6242,
e-mail: [obfuscate_1_|103|118|92|44|97|116|111|109|95|104|109|118|92|62|106|109|117|41|97|119]
Datum zahájení: 14. 10. 2025
Nábor probíhá
Randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie fáze III darolutamid/placebo + ADT u pacientů s vysoce rizikovou biochemickou rekurencí karcinomu prostaty.
Kód studie: 35/2023 fáze III
Číslo protokolu: 21492
Diagnózy: C61
Hlavní zkoušející: doc. MUDr. Michal Staník, Ph.D.
Koordinátoři:
Mgr. Viktor Komínek
tel.: 6246,
e-mail: [obfuscate_1_|116|105|102|114|108|112|46|102|109|106|103|110|96|105|61|107|111|112|44|96|120]
Datum zahájení: 20. 6. 2024
Nábor probíhá
Randomizovaná otevřená studie fáze 3 adjuvance pembrolizumab s nebo bez MK-2870 u pacientů s resekabilním stádiem II až IIIB (N2) NSCLC u pacientů po neoadjuvanci
Kód studie: 29/2023 fáze III
Číslo protokolu: MK-2870-019
Diagnózy: C340
Hlavní zkoušející: MUDr. Ondřej Bílek, Ph.D.
Datum zahájení: 9. 1. 2025
Nábor probíhá
Randomizované, dvojitě zaslepené, placebem a aktivním komparátorem kontrolované klinické hodnocení fáze 3 zkoumající V940 (mRNA-4157) plus pembrolizumab v adjuvanci ve srovnání s placebem plus pembrolizumab v adjuvanci u pacientů s resekovaným nemalobuněčným plicním karcinomem ve stádiu II, IIIA a IIIB
Kód studie: 23/2023 fáze III
Číslo protokolu: V940-002-01
Diagnózy: C340-C349
Hlavní zkoušející: MUDr. Ondřej Bílek, Ph.D.
Koordinátoři:
Bc. Kateřina Vavrouchová
tel.: 6220,
e-mail: [obfuscate_1_|105|97|111|99|111|103|110|92|44|115|95|118|109|109|114|97|104|106|116|94|62|109|106|115|43|97|122]
Datum zahájení: 22. 5. 2024
Nábor probíhá
Lomustin s reiradiací nebo bez ní u první progrese glioblastomu: randomizovaná studie fáze III (LEGATO)
Kód studie: 19A/2023 fáze III
Číslo protokolu: EORTC 2227-BTG
Diagnózy: C710-C719
Hlavní zkoušející: doc. MUDr. Tomáš Kazda, Ph.D.
Koordinátoři:
Mgr. Tereza Štěpánková
tel.: 6223,
e-mail: [obfuscate_1_|114|101|109|99|119|95|46|110|114|98|110|97|105|105|108|116|97|59|107|108|115|46|94|120]
Datum zahájení: 24. 4. 2024
Nábor probíhá
Randomizovaná, otevřená studie fáze III porovnávající MK-5684 verzus Abirateron (nebo Enzalutamid u pacientů s mCRCP u nichž došlo k progresi při nebo po předchozí léčbě některým z hormonálních přípravků NHA
Kód studie: 18/2023 fáze III
Číslo protokolu: MK5684-004
Diagnózy: C61
Hlavní zkoušející: MUDr. Jiří Navrátil, Ph.D.
Koordinátoři:
Bohumila Pavlasová
tel.: 6222,
e-mail: [obfuscate_1_|96|111|99|115|106|103|108|92|44|109|95|118|103|95|112|109|118|92|62|106|109|117|41|97|119]
Datum zahájení: 29. 4. 2024
Nábor probíhá
Randomizovaná, otevřená studie fáze III u pacientů s nonsquamózním NSCLC s mutací EGFR nebo jinou genomickou alterací po předchozí léčbě jednou nebo dvěma liniemi TKI a chemoterapií na bázi platiny při progresi na/po léčbě TKI (je dovoleno i podání anti PD-1/PD-L1).
Kód studie: 13/2023 fáze III
Číslo protokolu: MK-2870-004
Diagnózy: C349
Hlavní zkoušející: MUDr. Ondřej Bílek, Ph.D.
Koordinátoři:
Mgr. Viktor Komínek
tel.: 6246,
e-mail: [obfuscate_1_|116|105|102|114|108|112|46|102|109|106|103|110|96|105|61|107|111|112|44|96|120]
Datum zahájení: 11. 4. 2024
Nábor probíhá
OESOFIT: KOMPLEXNÍ PŘEDOPERAČNÍ A POSTOPERAČNÍ PROGRAM SESTÁVAJÍCÍ Z AKTIVNÍ FYZIOTERAPIE, KOMPLEXNÍHO NUTRIČNÍHO PLÁNU A PSYCHOLOGICKÉ PODPORY PRO PACIENTY S LOKÁLNĚ POKROČILÝM OPERABILNÍM KARCINOMEM JÍCNU, GASTROESOFAGEÁLNÍ JUNKCE A ŽALUDKU
Kód studie: 12N/2023 fáze
Číslo protokolu: NI-2023/2
Diagnózy: C150-C169
Hlavní zkoušející: doc.MUDr.Radka Lordick Obermannová, PhD.
Koordinátoři:
Bc. Natálie Pochopová
tel.: 6248,
e-mail: [obfuscate_1_|108|97|111|95|105|103|101|41|110|108|97|104|106|110|108|116|97|59|107|108|115|46|94|120]
Datum zahájení: 2. 5. 2023
Nábor probíhá
Multicentrická, randomizovaná, otevřená, aktivně kontrolovaná studie fáze III, hodnotící sotorasib, panitumumab a FOLFIRI oproti FOLFIRI s přípravkem bevacizumab awwb nebo bez něj u dosud neléčených účastníků s metastatickým kolorektálním karcinomem s mutací KRAS p.G12C
Kód studie: 41/2022 fáze III
Číslo protokolu: 20210081
Diagnózy: C180-C20
Hlavní zkoušející: prof. MUDr. Igor Kiss, Ph.D., MBA
Koordinátoři:
Bc. Iva Dvořáková
tel.: 6242,
e-mail: [obfuscate_1_|103|118|92|44|97|116|111|109|95|104|109|118|92|62|106|109|117|41|97|119]
Datum zahájení: 3. 3. 2025
Nábor probíhá
Prospektivní validační studie proteinových biomarkerů rakoviny plic v dechovém kondenzátu v pilotním skríninku ultranízkodávkovaným CT u pacientů se zvýšeným rizikem bronchogenního karcinomu
Kód studie: 38A/2022 fáze
Číslo protokolu: NI-2022/9
Diagnózy: všechny
Hlavní zkoušející: MUDr. Pavel Turčáni, Ph.D., MHA
Koordinátoři:
Ing. Bc. Dita Kozáková
tel.: 6236,
e-mail: [obfuscate_1_|98|105|111|95|43|105|111|117|95|104|109|118|92|62|106|109|117|41|97|119]
Datum zahájení: 22. 2. 2023
Nábor probíhá
Randomizovaná, nezaslepená studie fáze 3 s imlunestrantem podávaným v adjuvantní léčbě vs. standardní adjuvantní hormonální léčba u pacientů s ER+, HER2- časným karcinomem prsu se zvýšeným rizikem rekurence, kteří již podstoupili 2 až 5 let adjuvantní hormonální léčby.
Kód studie: 27/2022 fáze III
Číslo protokolu: J2J-MC-JZLH
Diagnózy: C500-C509
Hlavní zkoušející: MUDr. Marta Krásenská
Koordinátoři:
Bc. Iva Dvořáková
tel.: 6242,
e-mail: [obfuscate_1_|103|118|92|44|97|116|111|109|95|104|109|118|92|62|106|109|117|41|97|119]
Datum zahájení: 28. 4. 2023
Nábor probíhá
Multicentrická, otevřená studie fáze 1 hodnotící bezpečnost a předběžnou účinnost přípravku SOT201 u pacientů s pokročilými/metastatickými solidními nádory
Kód studie: 26F/2022 fáze I
Číslo protokolu: SC201 (VICTORIA-01)
Diagnózy: všechny
Hlavní zkoušející: doc.MUDr.Radka Lordick Obermannová, PhD.
Koordinátoři:
Bc. Kateřina Vavrouchová
tel.: 6220,
e-mail: [obfuscate_1_|105|97|111|99|111|103|110|92|44|115|95|118|109|109|114|97|104|106|116|94|62|109|106|115|43|97|122]
Datum zahájení: 12. 6. 2024
Nábor probíhá
Vliv řízené pohybové aktivity na dysbalanci autonomního nervového systému, imunitního systému a sníženou zdravotní zdatnost u onkologických pacientů po adjuvantní chemoterapii
Kód studie: 57N/2021 fáze
Číslo protokolu: NU21-09-00558
Diagnózy: všechny
Hlavní zkoušející: prof. MUDr. Igor Kiss, Ph.D., MBA
Datum zahájení: 1. 5. 2021
Nábor probíhá
ScrePan: Screening karcinomu pankreatu u osob s vysokým rizikem
Kód studie: 56N/2021 fáze
Číslo protokolu: MOU-2021-01
Diagnózy: C250-C259,K861
Hlavní zkoušející: MUDr. Petr Karásek, Ph.D.
Koordinátoři:
Ing. Bc. Dita Kozáková
tel.: 6236,
e-mail: [obfuscate_1_|98|105|111|95|43|105|111|117|95|104|109|118|92|62|106|109|117|41|97|119]
Datum zahájení: 6. 10. 2021
Nábor probíhá
Akupunktura u muskuloskeletálního syndromu navozeného inhibitory aromatázy u pacientek s časným karcinomem prsu
Kód studie: 55N/2021 fáze
Číslo protokolu: AKU
Diagnózy: C501-C509
Hlavní zkoušející: doc. MUDr. Jana Halámková, Ph.D.
Koordinátoři:
Bc. Renata Hurníková
tel.: 6243,
e-mail: [obfuscate_1_|112|101|105|95|113|95|46|99|115|111|108|105|102|109|115|95|64|104|109|114|44|99|117]
Datum zahájení: 31. 8. 2021
Nábor probíhá
Multicentrická studie fáze 1/2 hodnotící bezpečnost a účinnost přípravku SOT102 v monoterapii a v kombinaci se standardní léčbou u pacientů s adenokarcinomem žaludku a pankreatu.
Kód studie: 49R/2021 fáze I
Číslo protokolu: SN201
Diagnózy: C160,C250-C259,C150-C169
Hlavní zkoušející: MUDr. Radka Obermannová, Ph.D.
Koordinátoři:
Bc. Kateřina Vavrouchová
tel.: 543136220,
e-mail: [obfuscate_1_|105|97|111|99|111|103|110|92|44|115|95|118|109|109|114|97|104|106|116|94|62|109|106|115|43|97|122]
Datum zahájení: 23. 3. 2022
Nábor probíhá
Multicentrické, randomizované, otevřené klinické hodnocení fáze III se zaslepeným vyhodnocením cílových parametrů, porovnávající účinek abelacimabu ve srovnání s dalteparinem na recidivu žilní tromboembolie (VTE) a krvácení u pacientů s VTE související s nádorovým onemocněním gastrointestinálního (GI) / urogenitálního (UG) traktu
Kód studie: 44/2021 fáze III
Číslo protokolu: ANT-008
Diagnózy: všechny
Hlavní zkoušející: MUDr. Tomáš Pokrivčák
Koordinátoři:
Bc. Renata Hurníková
tel.: 6243,
e-mail: [obfuscate_1_|112|101|105|95|113|95|46|99|115|111|108|105|102|109|115|95|64|104|109|114|44|99|117]
Datum zahájení: 19. 12. 2022
Nábor probíhá
Multicentrické, randomizované, otevřené klinické hodnocení fáze III se zaslepeným vyhodnocením cílových parametrů, porovnávající účinek abelacimabu ve srovnání s apixabanem na recidivu žilní tromboembolie (VTE) a krvácení u pacientů s VTE související s nádorovým onemocněním
Kód studie: 43/2021 fáze III
Číslo protokolu: ANT-007
Diagnózy: všechny
Hlavní zkoušející: MUDr. Tomáš Pokrivčák
Koordinátoři:
Bc. Renata Hurníková
tel.: 6243,
e-mail: [obfuscate_1_|112|101|105|95|113|95|46|99|115|111|108|105|102|109|115|95|64|104|109|114|44|99|117]
Datum zahájení: 19. 12. 2022
Nábor probíhá
Otevřené, randomizované, kontrolované, globální klinické hodnocení fáze 3 hodnotící telisotuzumab vedotin (ABBV-399) oproti docetaxelu u subjektů s dříve léčeným lokálně pokročilým/metastatickým neskvamózním nemalobuněčným karcinomem plic s nadměrnou expresí c-Met a EGFR divokého typu
Kód studie: 33/2021 fáze III
Číslo protokolu: M18-868
Diagnózy: C342
Hlavní zkoušející: MUDr. Ondřej Bílek, Ph.D.
Koordinátoři:
Bc. Markéta Skoupá
tel.: 6224,
e-mail: [obfuscate_1_|107|97|109|105|98|114|97|41|113|104|109|117|107|95|61|107|111|112|44|96|120]
Datum zahájení: 26. 9. 2022
Nábor probíhá
Klinické hodnocení fáze I nového orálně podávaného platinového komplexu TU31 u pacientů se solidními nádory.
Kód studie: 18F/2021 fáze I
Číslo protokolu: TU31-KH1
Diagnózy: všechny
Hlavní zkoušející: doc.MUDr.Radka Lordick Obermannová, PhD.
Koordinátoři:
Bc. Kateřina Vavrouchová
tel.: 6220,
e-mail: [obfuscate_1_|105|97|111|99|111|103|110|92|44|115|95|118|109|109|114|97|104|106|116|94|62|109|106|115|43|97|122]
Datum zahájení: 1. 6. 2022
Nábor probíhá
Modulové, otevřené, multicentrické klinické hodnocení fáze I/IIa, jehož cílem je posoudit bezpečnost, snášenlivost, farmakokinetiku, farmakodynamiku a předběžnou účinnost zvyšujících se dávek přípravku AZD5305 použitého samostatně nebo v kombinaci s jinou léčbou proti rakovině jako léčba u pacientů s pokročilými solidními nádory (PETRA)
Kód studie: 8R/2021 fáze I/II
Číslo protokolu: D9720C00001
Diagnózy: C180-C189,C500-C509,C56,C169,C240,C20
Hlavní zkoušející: MUDr. Miloš Holánek, Ph.D.
Koordinátoři:
Mgr. Lenka Reviľáková
tel.: 6227,
e-mail: [obfuscate_1_|106|101|105|105|94|44|114|96|116|102|106|97|102|109|115|95|64|104|109|114|44|99|117]
Datum zahájení: 15. 7. 2021
Nábor probíhá
Randomizovaná studie fáze III s neodjuvantní chemoterapií s následnou operací versus operace samotná u pacientů s retroperitoneálním sarkomem vysokého rizika.
Kód studie: 28A/2019 fáze III
Číslo protokolu: 1809-STBSG
Diagnózy: C480
Hlavní zkoušející: MUDr. Dagmar Adámková, Ph.D.
Koordinátoři:
Mgr. Lenka Reviľáková
tel.: 6227,
e-mail: [obfuscate_1_|106|101|105|105|94|44|114|96|116|102|106|97|102|109|115|95|64|104|109|114|44|99|117]
Datum zahájení: 4. 1. 2021
Nábor probíhá
ANTABUS - 2. fáze otevřené klinické studie s disulfiramem a mědí pro pacientky s metastazujícím karcinomem prsu
Kód studie: 2A/2018 fáze II
Číslo protokolu: 2016/1-DSF-MBC
Diagnózy: C500 -C509
Hlavní zkoušející: MUDr. Miloš Holánek, Ph.D.
Koordinátoři:
Mgr. Martina Vaněčková
tel.: 6245,
e-mail: [obfuscate_1_|107|97|109|114|102|108|97|41|116|94|108|101|94|105|108|116|97|59|107|108|115|46|94|120]
Datum zahájení: 29. 5. 2018
Nábor probíhá
Klinické studie
Péče a služby
Bezplatná nádorová telefonní linka
Po–Pá od 8:00 do 15:00 hodin
(+420)800 222 322